O que é inibição alostérica , como funciona e como é diferente da inibição competitiva?
As enzimas não devem ter um efeito permanente no organismo. Por quê? Porque senão as reações bioquímicas ocorreriam ao mesmo tempo com (relativamente) alta velocidade. Quando não são necessários, são inibidos, na maioria das vezes por um inibidor .
As enzimas podem ser inibidas de forma irreversível ou reversível . A reversível pode proceder por mecanismos competitivos ou não competitivos. A inibição alostérica de enzimas é um dos três modos de inibição.
A inibição alostérica é um tipo de inibição enzimática. Um inibidor, também chamado de inibidor, liga-se à enzima. Isso não acontece no centro ativo, mas no centro alostérico. Um centro alostérico é uma região da enzima que causa a chamada mudança conformacional por ligação. Devido à estrutura espacial então alterada (=conformação) da enzima, o substrato só pode acoplar ao centro ativo com dificuldade ou não.
A inibição alostérica é um caso especial de inibição não competitiva porque o inibidor não compete com o substrato. Ambos se ligam a centros diferentes. Além disso, a inibição alostérica é reversível, ou seja, pode ser revertida novamente.
A inibição alostérica leva a uma perda parcial ou completa da função da enzima.
O termo alosteria descreve o processo de alteração da estrutura espacial de uma enzima de tal forma que o centro ativo é influenciado.
A inibição alostérica simplesmente explicada
A inibição alostérica é um tipo de inibição enzimática . Em contraste com a inibição competitiva, o inibidor alostérico liga -se ao centro alostérico da enzima a uma distância do centro ativo . Essa inibição não competitiva leva a uma mudança no centro ativo, de modo que o substrato só pode se ligar à enzima com grande dificuldade ou não se liga e nenhum produto é formado.
Já sabia? A inibição alostérica é uma estratégia importante para regular o metabolismo.
A inibição alostérica é reversível ( reversível ). Isso significa que, embora a enzima seja desligada pelo inibidor, ela também é ligada novamente quando o inibidor se desprende do centro alostérico. Definição de inibição alostérica
A inibição alostérica (grego para ‘outro lugar’) é uma inibição enzimática reversível e não competitiva . O inibidor não se liga ao centro ativo, mas sim ao centro alostérico. Devido a uma mudança na conformação do centro ativo, o substrato só pode se ligar com dificuldade ou não se ligar.
As enzimas alostéricas geralmente catalisam o primeiro passo em uma cadeia biossintética e são inibidas alostericamente pelo produto final da cadeia biossintética correspondente. O processo é chamado de cadeia alostérica do produto final , retroalimentação negativa ou inibição por retroalimentação .
As enzimas alostéricas geralmente catalisam o primeiro passo em uma cadeia biossintética e são inibidas alostericamente pelo produto final da cadeia biossintética correspondente. O processo é chamado de cadeia alostérica do produto final , retroalimentação negativa ou inibição por retroalimentação .

Inibição alostérica e inibição não competitiva
A inibição alostérica é um caso especial de inibição não competitiva . Isso significa que o inibidor – também chamado de efetor alostérico ou inibidor alostérico – não compete diretamente com o substrato por um lugar no sítio ativo. Em vez disso, o inibidor causa uma mudança (mudança na conformação) do centro ativo ao se acoplar ao centro alostérico . Como resultado, é difícil ou impossível que o substrato se ligue ao centro ativo da enzima. Isso inibe a enzima e prejudica a formação do produto.Definição de Inibição Não Competitiva
A inibição não competitiva é um tipo de inibição enzimática. O inibidor não compete com o substrato pelo sítio ativo da enzima, mas impede a produção do produto ligando-se a um sítio diferente da enzima ou ao substrato.
Processo de inibição alostérica
A inibição alostérica geralmente funciona de acordo com o seguinte princípio :
- O inibidor liga-se ao centro alostérico.
- Isso altera a estrutura espacial (conformação) da enzima.
- Devido à mudança na conformação, o substrato só pode se ligar à enzima com dificuldade ou não se liga.
O processo de alterar a estrutura espacial de uma enzima de tal forma que afete o sítio ativo é o que você chama de alosteria .
Influência da Concentração do Inibidor
A concentração de inibidor desempenha um papel na inibição alostérica:
- Concentração baixa : Isso significa que existem poucos inibidores em comparação com os substratos. Nesse caso, a maioria das enzimas é ocupada por um substrato, que você chama de complexo enzima-substrato. A enzima é então ligada e pode realizar sua função. Atua como um catalisador, ajudando a formar um produto.
- Concentração alta : Aqui é exatamente o oposto. Existem muito mais inibidores do que substratos. Por esta razão, o centro alostérico de várias enzimas é ocupado por um inibidor. Isso altera a forma da enzima e a maioria dos substratos não pode mais se ligar ao centro ativo – a enzima é, portanto, desligada . Nenhuma reação é então possível e nenhum produto é formado.
Exemplo de inibição alostérica
Um exemplo de inibição alostérica é a regulação da produção de ATP durante a quebra da glicose ( glicólise ). Esta é uma inibição do produto final, então o produto final ATP regula a atividade da enzima fosfofrutoquinase.
Funciona assim:
- Quando seu corpo precisa de energia, geralmente a obtém na forma de ATP (trifosfato de adenosina), um transportador universal de energia. O chamado ADP (difosfato de adenosina), por outro lado, é o produto de degradação do ATP. Ocorre quando a energia já foi utilizada.
- Se o seu corpo agora tem muito ADP e pouco ATP , apenas pouca energia é armazenada.
- Isso ativa a enzima fosfofrutoquinase . Sua tarefa é produzir o açúcar frutose-6-bifosfato a partir da frutose-6-fosfato. É somente por meio dessa etapa que o açúcar pode ser decomposto ainda mais, o que significa que a energia pode ser recuperada.
- Durante este processo ( glicólise ), a energia é armazenada novamente na forma de ATP .
- Se houver muito ATP , mas apenas um pouco de ADP, o ATP se liga ao centro alostérico da enzima.
- O ATP atua como seu próprio inibidor porque inibe a fosfofrutoquinase e, portanto, a produção de mais ATP.
- Se o ATP for usado novamente em algum momento, haverá novamente muito ADP e o processo começará novamente.
Como o produto final ATP se torna o inibidor alostérico, você pode chamar o processo de inibição do produto final .
inibição do produto final
A inibição alostérica pode ser a inibição do produto final.
A inibição do produto final ocorre quando a atividade de uma enzima produz um produto final que, por sua vez, impede a atividade da enzima original. Isso significa que a enzima se inibe formando o produto. Você também chama esse processo de feedback negativo ou inibição de feedback .
A inibição do produto final é uma estratégia importante para regular o metabolismo .
Taxa de inibição alostérica da reação
Uma coisa importante a saber sobre a inibição enzimática é a velocidade da reação . Mais especificamente, como a inibição alostérica afeta a taxa de reação de uma reação enzimática.
O inibidor alostérico garante que a velocidade máxima da reação enzimática ( vmax ) seja menor do que sem o inibidor. Isso ocorre porque o inibidor desativa algumas enzimas. Como resultado, menos substratos podem se ligar às enzimas em geral. A reação enzimática, portanto, prossegue mais lentamente com o inibidor alostérico do que sem o inibidor.
No entanto, você também pode ver na figura que o inibidor não pode impedir completamente que o substrato se ligue à enzima. Isso acontece especialmente quando a concentração do substrato é aumentada.
Calcular a velocidade de reação
A chamada equação de Michaelis-Menten descreve a dependência da taxa de reação de uma reação enzimática da concentração do substrato .
A equação de Michaelis-Menten fica assim:
![Renderizado por QuickLaTeX.com v_0=\frac{v_m_a_x\cdot[S]} {K_M+[S]}](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-db883e9620c4fedce78df3e24c5e5f55_l3.png)
Aplica-se o seguinte:
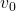 = taxa inicial =
= taxa inicial =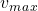 taxa máxima de reação
taxa máxima de reação![[S]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-93d0aab0997c910928e9b381f4af9d06_l3.png) = concentração de substrato
= concentração de substrato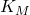 = constante de Michaelis-Menten
= constante de Michaelis-Menten
Se você precisar calcular uma das quantidades mencionadas em relação às reações enzimáticas, use esta equação.
Inibição competitiva e não competitiva
Além da inibição não competitiva , que também inclui a inibição alostérica, há também a inibição competitiva . Assim, como os nomes dizem, a inibição competitiva é o oposto da inibição não competitiva. As principais diferenças entre as duas formas de inibição são :
- Sítio de ligação do inibidor: Na inibição competitiva, o inibidor se liga ao sítio ativo da enzima, enquanto na inibição não competitiva, o inibidor se liga ao sítio alostérico da enzima.
- Semelhança de substrato e inibidor: O inibidor competitivo é extremamente semelhante ao substrato porque o sítio de ligação é o mesmo. Como resultado, o inibidor competitivo também compete diretamente com o substrato. O inibidor não competitivo, por outro lado, não se assemelha ou compete diretamente com o substrato.
Você quer saber exatamente como funciona a inibição competitiva? Então assista nosso vídeo sobre isso a seguir!
Inibição alostérica – a mais importante
- Na inibição alostérica, um inibidor liga-se ao centro alostérico da enzima.
- Essa ligação altera a estrutura espacial da enzima, razão pela qual o substrato não pode se ligar ao centro ativo da enzima.
- A inibição alostérica é reversível.
- A velocidade máxima de reação não é alcançada com a inibição alostérica porque o inibidor impede a conversão dos substratos.
inibição alostérica
Como funciona a inibição alostérica?
Um inibidor, também chamado de inibidor, liga-se à enzima. Isso não acontece no centro ativo, mas no centro alostérico. Um centro alostérico é uma região da enzima que causa a chamada mudança conformacional por ligação. Devido à estrutura espacial então alterada (=conformação) da enzima, o substrato só pode acoplar ao centro ativo com dificuldade ou não.
O que é inibição alostérica?
A inibição alostérica é um tipo de inibição enzimática. As enzimas não podem ter um efeito permanente no corpo porque, caso contrário, muitas reações bioquímicas ocorreriam ao mesmo tempo em alta velocidade.
A inibição alostérica é reversível?
A inibição alostérica é reversível e, portanto, reversível. É também uma forma especial de inibição não competitiva, uma vez que o inibidor não compete com o substrato.
O que é uma enzima alostérica?
As enzimas alostéricas muitas vezes catalisam o primeiro passo em uma cadeia biossintética e têm um centro ativo e um regulador. A ligação e a conversão ocorrem no site ativo. No centro regulador, o efetor atua inibindo ou ativando enzimas.