A constante de Michaelis-Menten K M é um parâmetro na equação de Michaelis-Menten. Mas o que significa um K M baixo e um alto ? Você vai descobrir neste artigo .
A constante de Michaelis recebeu o nome do químico alemão-americano LEONOR MICHAELIS (1875-1949), que pesquisou reações redox em sistemas vivos e os radicais livres resultantes. Em 1912, juntamente com MAUD MENTEN (1879-1960), desenvolveu a equação de Michaelis-Menten, que descreve a dependência da velocidade de uma reação catalisada por enzimas da concentração do substrato.
A constante de Michaelis caracteriza a afinidade da enzima ao seu substrato. Corresponde à concentração de substrato na qual metade da velocidade máxima de reação é atingida. Se a velocidade da reação é medida em função da concentração de substrato para uma dada quantidade constante de enzima, uma curva é frequentemente observada a partir da qual a concentração de substrato KM, na qual a meia saturação da enzima é alcançada, pode ser lida, entre outras coisas. Assim, os valores de KM são uma medida da força de ligação entre a enzima e o substrato.

Em baixas concentrações de substrato, a taxa de reação pode ser aumentada aumentando a concentração de substrato, uma vez que nem todas as moléculas de enzima são ocupadas por moléculas de substrato. Uma concentração mais alta do substrato aumenta então a conversão global através de uma melhor utilização das moléculas da enzima.
Em altas concentrações de substrato, todas as moléculas de enzimas estão ocupadas; saturação é atingida.
A taxa de degradação enzima-substrato limita a taxa de reação. Ele não pode mais ser aumentado aumentando ainda mais a concentração do substrato. O valor máximoVmáximoé atingido. Taxas de reação mais altas só seriam alcançadas pela adição de mais enzimas.
Sob condições fisiológicas, uma baixa concentração de substrato é importante. A concentração, que é metade da velocidade máxima, é considerada o parâmetro para enzimas12Vmáximoalcançou. É chamada de constante de Michaelis . é o seu valorPARAM(mol/l). Os valores das enzimas estão entre10−7e10−1mol/l.
A equação de Michaelis-Menten descreve a dependência da velocidade de uma reação enzimática da concentração do substrato a ser convertido. A concentração de substrato na qual a taxa de reação v atingiu metade da taxa máxima Vmax é chamada de constante de Michalis KM.
Constante de Michaelis-Menten simplesmente explicada
A constante de Michaelis-Menten K M (muitas vezes também constante de Michaelis ou constante de Michaelis Menten) corresponde à concentração de substrato na qual metade das enzimas são ocupadas por um substrato. Você também se refere à constante de Michaelis-Menten como o valor K M ( valor K M ).
Você pode usar o valor de K M para descobrir quão “provável” uma enzima se associa ao substrato apropriado. Você também chama isso de afinidade enzimática . Como de costume para concentrações, a unidade do valor K M é 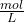 . Um valor baixo de KM significa que a afinidade entre a enzima e o substrato é alta. A partir de um valor alto de KM pode -se concluir que a afinidade entre enzima e substrato é baixa.definição
. Um valor baixo de KM significa que a afinidade entre a enzima e o substrato é alta. A partir de um valor alto de KM pode -se concluir que a afinidade entre enzima e substrato é baixa.definição
A constante de Michaelis-Menten K M corresponde àquela concentração de substrato na qual metade da velocidade máxima de reação é atingida. É uma referência comum para afinidade enzimática e atividade enzimática.
Atividade enzimática em diferentes concentrações de substrato
| PARAM-Níveis de algumas enzimas | ||
| enzima | Substrato | PARAM-Valor (mol/l) |
| Catalase | H2O | 2,5⋅10-2 |
| Hexoquinase | Glicose | 1,5⋅10-2 |
| Lisozima | Acetilglucosamina | 6⋅10-6 |
| Glutamat-Desidrogenase | Glutamato | 1,2⋅10-4 |
Os números de turnover de muitas enzimas agora também são conhecidos. Eles indicam quantas moléculas de substrato uma molécula de enzima converte em um segundo.
| Números de rotatividade de algumas enzimas | |
| enzima | Número máximo de alterações (número/s) |
| Acetilcolinesterase | 25 000 |
| Lactatodesidrogenase | 1 000 |
| Quimotripsina | 100 |
| DNA-polimerase | 15 |
Calcule a constante de Michaelis-Menten
Você pode calcular o valor de K M usando a equação de Michaelis-Menten .
A equação é:
![Renderizado por QuickLaTeX.com v_0=\frac{v_m_a_x\cdot[S]} {K_M+[S]}](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-db883e9620c4fedce78df3e24c5e5f55_l3.png)
Para fazer isso, você deve reorganizar a equação de acordo com K M :
![Renderizado por QuickLaTeX.com K_M=\frac{v_m_a_x\cdot[S]} {v_0} -[S]](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-311dbe2512eb5774b92f040d8757b073_l3.png)
Agora tudo que você precisa fazer é inserir as quantidades e você já calculou a constante de Michaelis-Menten.
Estado estacionário constante de Michaelis-Menten
A constante de Michaelis-Menten consiste em três constantes de velocidade . As constantes de velocidade vêm do estado estacionário simplificado de uma reação enzimática.
E significa enzima, S para substrato e P para produto. Você chama ES o complexo enzima-substrato. K 1 , k -1 e k 2 são as constantes de velocidade.
K M resulta de uma fração. As constantes que se afastam de ES estão no numerador. A constante que leva a ES está no denominador.
Matematicamente, você expressa assim:
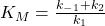
A formação do complexo enzima-substrato geralmente ocorre mais rapidamente do que a formação do produto. Nesse caso, você pode desprezar k 2 e simplificar um pouco a fórmula:
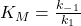
Você chama a expressão para K M constante de dissociação .
Interpretação do baixo valor de K M
Se o valor de KM for pequeno, significa que a afinidade entre a enzima e o substrato é alta. Você pode 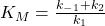 derivar isso da fórmula. Quando o valor de K M é baixo , o numerador é pequeno e o denominador é grande. Assim, a constante k 1 é maior do que as constantes k -1 e k 2 combinadas. A formação do complexo ES é, portanto, mais rápida do que a decomposição do complexo ES. Isso permite que você descreva a afinidade entre a enzima e o substrato como alta .
derivar isso da fórmula. Quando o valor de K M é baixo , o numerador é pequeno e o denominador é grande. Assim, a constante k 1 é maior do que as constantes k -1 e k 2 combinadas. A formação do complexo ES é, portanto, mais rápida do que a decomposição do complexo ES. Isso permite que você descreva a afinidade entre a enzima e o substrato como alta .
Você pode ver isso no diagrama também. Quando o valor de K M é baixo, o gráfico é relativamente íngreme. Este é um sinal de que muitas enzimas estão ocupadas por um substrato. Assim que o gráfico atinge a velocidade máxima v max , seu valor não muda mais. O estado que você chama de saturação é então alcançado. Portanto, você chama a função de função de saturação .
Interpretação do alto valor K M
Quando o valor de K M é alto , o numerador é grande e o denominador é pequeno. Assim, as constantes k -1 e k 2 juntas são maiores que a constante k 1 . O decaimento do complexo ES é, portanto, mais rápido do que a formação do complexo ES. Portanto, você pode descrever a afinidade entre a enzima e o substrato como baixa .
Você pode reconhecer rapidamente um valor baixo de K M no diagrama . Quando o valor de K M é maior, a curva geral é mais plana e a resposta é mais lenta. Isso ocorre porque poucas enzimas estão ocupadas com um substrato. Leva mais tempo até que a velocidade máxima v max seja alcançada.
Atividade enzimática em diferentes concentrações de substrato
Você pode usar a constante de Michaelis-Menten para descrever a afinidade da enzima e, portanto, também a atividade da enzima quando a concentração muda.
Se a concentração de substrato for baixa, a atividade da enzima também será baixa. No entanto, a velocidade de reação ainda pode ser aumentada. Para isso, você precisa aumentar a concentração do substrato. Como resultado, mais enzimas são ocupadas com um substrato e a reação prossegue mais rapidamente. Assim, a atividade enzimática aumenta.
Se a concentração de substrato for alta, a reação já é muito rápida e a atividade da enzima é muito alta. A partir de um certo ponto, ou seja, em v max , a reação não pode mais ser mais rápida. Isso ocorre porque todas as enzimas já estão ocupadas com um substrato. Você chama esse estado de saturação . Para aumentar ainda mais a velocidade da reação, você teria que aumentar a concentração da enzima .