A pressão osmótica permite que os solventes passem através de uma membrana. Mas como exatamente isso funciona?
A pressão osmótica é a pressão que prevalece entre dois líquidos separados por uma membrana semipermeável. Nesse momento, o solvente flui do lado com menor concentração de moléculas para o de maior concentração de moléculas. As próprias partículas/moléculas não podem passar pela membrana. Isso é importante para a biologia e a medicina. As membranas biológicas são membranas semipermeáveis. A pressão osmótica desempenha um papel importante no transporte de substâncias no corpo e na função saudável das células sanguíneas.
A pressão osmótica é a pressão causada pelas moléculas dissolvidas em um solvente no lado mais concentrado, que impulsiona o fluxo do solvente (geralmente água) através de uma membrana semipermeável .
O solvente flui do lado com menor concentração de partículas através da referida membrana para o lado com maior pressão osmótica, isto é, para a maior concentração de partículas. A membrana não pode ser atravessada pelas próprias partículas.
A pressão osmótica simplesmente explicada
A pressão osmótica é a pressão que prevalece entre dois líquidos quando eles têm concentrações diferentes e são separados por uma membrana semipermeável, ou seja , semipermeável. A pressão faz com que o solvente (por exemplo , água ) flua do lado da concentração de partículas mais baixa para a mais alta.
Você pode imaginar a influência da pressão osmótica da seguinte forma:
- Existem dois espaços separados por uma membrana semipermeável .
- Ambas as áreas contêm solvente com partículas dissolvidas . No entanto, uma área tem mais partículas dissolvidas (maior concentração).
- A diferença na concentração cria a pressão osmótica no lado com a maior concentração de partículas.
- Isso faz com que o solvente se mova do lado de menor concentração de partículas para o lado de maior concentração de partículas até que a razão de pressão seja equalizada.
Definição de pressão osmótica
A pressão osmótica é uma pressão causada pelas partículas dissolvidas em um solvente no lado mais concentrado.
A pressão osmótica depende das razões de concentração das duas soluções em cada lado da membrana. A pressão osmótica é maior no lado com maior concentração de soluto.
Um influxo de água do interstício para as células ocorre do lado de menor concentração para o lado de maior concentração até que a pressão interna das células ( turgor ) seja equivalente à pressão osmótica do lado de fora.
efeito osmótico
A melhor maneira de entender a pressão osmótica é imaginar dois recipientes separados por uma membrana. A membrana é semipermeável . Isso significa que só permite a passagem de certas moléculas. No caso de osmose , apenas o solvente pode se difundir através da membrana.
Funciona assim:
- Existem menos partículas dissolvidas por solvente no primeiro recipiente do que no segundo recipiente. Assim, ou menos partículas são dissolvidas na mesma quantidade de solvente (concentração de partículas) ou mais solvente foi usado para a mesma quantidade de partículas (concentração de solvente).
- Devido à concentração diferente , surge uma pressão osmótica no recipiente com maior concentração de partículas ou com menor concentração de solvente.
- Para equalizar a pressão osmótica, o solvente flui através da membrana do reservatório com a menor concentração de partículas para o reservatório com a maior concentração de partículas. Assim, o solvente se move para o lado onde existe a pressão osmótica. Isso ocorre até que a relação de pressão seja equilibrada .

As mesmas leis físicas se aplicam em soluções líquidas diluídas como em gases ideais. Aplica-se que a pressão osmótica
- é proporcional à concentração molar da substância dissolvida no líquido
- depende apenas do número de partículas na substância dissolvida
- é proporcional à temperatura absoluta
A pressão osmótica de uma solução de 1 mol de substância em 22,4 l de solvente a 0°C (273,15 K) é 101,325 k Pa . Essas relações são formuladas pela lei de van ‘t Hoff, que, no entanto, só se aplica a soluções diluídas (< 0,1 M).
| Π = cx R x T |
- Π = pressão osmótica (em pascal)
- c = concentração molar da solução
- R = constante de gás universal
- T = temperatura absoluta (em Kelvin )
Classificação da pressão osmótica
Você pode nomear a medida da pressão osmótica da seguinte forma:
- Isotônico : A concentração de solutos é a mesma em ambos os lados da membrana. Isso significa que nenhuma pressão osmótica é criada e, portanto, nenhum solvente se difunde.
- hipertônico : a concentração de solutos é menor em um lado (por exemplo, dentro da célula ) da membrana do que no outro lado (por exemplo, fora da célula ). Isso significa que uma pressão osmótica é criada fora da célula. Isso permite que o solvente se difunda para fora da célula.
- hipotônico : a concentração de solutos é maior em um lado (por exemplo, dentro da célula ) do que no outro lado da membrana (por exemplo, fora da célula ). Isso cria uma pressão osmótica dentro da célula. O solvente difunde-se assim na célula.
Você está procurando experiências que irão beneficiá-lo por toda a vida?

Calcule a pressão osmótica
Você pode calcular a pressão osmótica. Para isso, você usa a lei de Van ‘t Hoff.
Aquilo é:
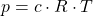
onde p representa a pressão osmótica. A unidade de pressão osmótica é pascal. A concentração molar dissolvida é descrita por c , R representa a constante universal do gás e T é a temperatura.
Então, para calcular a pressão osmótica, você deve inserir as quantidades dadas na fórmula da pressão osmótica.
Medir a pressão osmótica
Você não apenas pode calcular a pressão osmótica, mas também medi -la . Você usa um chamado osmômetro para isso. O botânico Wilhelm Pfeffer desenvolveu um aparelho para medir a pressão osmótica em soluções aquosas. Você chama o aparelho de célula de pimenta .
A célula de Pfeffer é um modelo de célula vegetal e funciona assim :
- A substância a ser medida (por exemplo , uma solução de açúcar ) é colocada em um recipiente.
- A embarcação é fechada com uma rolha, na qual ainda existe um riser. Há uma parede de argila permeável à água ao redor do vaso.
- O recipiente é então colocado em água limpa.
- Agora a água pode se difundir através da membrana semipermeável para a solução de açúcar. Isso faz com que a solução de açúcar no riser suba.
- O líquido sobe no tubo ascendente até que a pressão em ambos os lados esteja equilibrada.
- Finalmente, você pode ler a pressão osmótica no riser no ponto em que o líquido subiu. O valor que você lê também é chamado de valor osmótico .
Célula de pressão osmótica
Cada célula está sujeita a uma certa pressão osmótica. As células animais não são cercadas por uma parede celular, mas por uma membrana celular. Uma membrana celular muitas vezes não pode suportar pressões tão grandes quanto uma parede celular.
exemplos de osmose
Como exemplo, vejamos a pressão osmótica no sangue . Os glóbulos vermelhos são normalmente encontrados no corpo como discos. No entanto, se você diluí-los com água pura, eles vão estourar. Isso ocorre porque a membrana não pode suportar a pressão do fluxo de entrada de água. Por esse motivo, o sangue é diluído apenas com uma solução isotônica .
A situação é diferente nas células vegetais , que possuem uma parede celular estável. Eles suportam e até precisam da pressão osmótica que ocorre quando absorvem água. Porque a pressão interna da célula ou turgor se acumula como resultado da osmose.
Em seguida, assista ao nosso vídeo Turgor e descubra para que as plantas precisam e o que isso tem a ver com o murchamento das plantas!