A equação de Michaelis-Menten faz parte da cinética de Michaelis-Menten. Mas como é a fórmula e como é o diagrama que a acompanha? Você pode descobrir neste artigo .
No início do século 20, os dois cientistas Michaelis e Menten desenvolveram um conceito que tornou mais fácil descrever a cinética enzimática – ou seja, a rapidez com que uma reação controlada por enzimas ocorre. Para perpetuar seus nomes na história, eles a chamaram de “cinética Michaelis-Menten”.
Embora a equação que eles formularam seja apenas uma representação muito simplificada, ela ainda pode ser usada para descrever a taxa de reação da maioria das reações enzimáticas.
Afinal, o que é uma enzima?
Uma enzima é uma proteína especial que acelera ou catalisa reações bioquímicas para que não demorem tanto. Portanto, uma enzima é umbiocatalisador.
E o que se entende por uma reação enzimática controlada?
Em uma reação controlada enzimaticamente, as enzimas catalisam uma reação bioquímica que produz um produto a partir de um substrato.
Eles fazem isso ligando-se reversivelmente ao substrato e formando um complexo enzima-substrato com ele . No centro catalítico da enzima, o substrato é agora convertido em produto. Este produto se separa da enzima, deixando o produto e a enzima no final da reação.
A equação de Michaelis-Menten descreve a dependência da taxa de conversão da enzima na concentração do substrato e pode, assim, prever a taxa de uma reação ocorrendo. É sempre assumido que a concentração da enzima permanece constante e a velocidade da reação, portanto, depende apenas da concentração do substrato.
Portanto, se você está executando uma reação enzimática em seu laboratório doméstico e quer saber se tem tempo para ir ao cinema com seus amigos, a equação de Michaelis-Menten é para você.
Como a equação de Michaelis-Menten é apenas uma simplificação, alguns pré-requisitos devem ser atendidos para usá-la corretamente:
Um substrato e uma enzima sempre formam um complexo enzima-substrato. Uma enzima não pode ligar vários substratos ao mesmo tempo ou vice-versa.
A reação está em estado estacionário. Simplificando, isso significa que a concentração do complexo enzima-substrato permanece constante ao longo do tempo. Assim, todos os substratos presentes se ligam imediatamente, no início da reação, a todas as enzimas presentes.
O produto e a enzima não formam seu próprio complexo. A afinidade da enzima pelo produto é, portanto, zero e o produto não pode retirar nenhuma enzima do substrato.
A balança fica na lateral do produto. Existem substratos mais do que suficientes ( excesso de substrato ) e a reação não é retardada por falta de substrato.

Ao mesmo tempo, a formação do produto é a etapa limitante da velocidade da reação, não a formação do complexo enzima-substrato. Ou seja, a etapa de formação do produto é a etapa mais lenta.
Se todos esses requisitos forem atendidos, você poderá trabalhar com a equação de Michaelis-Menten sem problemas.
Equação de Michaelis-Menten simplesmente explicada
A equação de Michaelis-Menten (muitas vezes também: equação de Michaelis Menten) recebeu o nome de Leonor Michaelis e Maud Menten. Ele descreve a dependência da taxa de reação de uma reação enzimática na concentração do substrato. Então a equação fica assim:
![Renderizado por QuickLaTeX.com v_0=\frac{v_m_a_x\cdot[S]} {K_M+[S]}](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-db883e9620c4fedce78df3e24c5e5f55_l3.png)
onde v 0 é a taxa inicial, v max é a taxa de reação máxima, [S] é a concentração de substrato e K M é a constante de Michaelis-Menten.
Definição da equação de Michaelis-Menten
A equação de Michaelis-Menten faz parte da cinética de Michaelis Menten e descreve a dependência da taxa de reação de uma reação enzimática da concentração do substrato.
Aqui está a explicação dos componentes individuais:
é a velocidade inicial da reação. Em outras palavras, a velocidade na qual ainda não há produto, mas a concentração máxima de substrato.
é a velocidade máxima que a reação pode atingir. Ela é alcançada quando todas as enzimas estão ocupadas com um substrato. A partir daqui, a quantidade de substrato não influencia mais na velocidade da reação, pois todas as enzimas já estão ocupadas e o estado de saturação é atingido. Somente quando mais enzimas são adicionadas, que podem ligar o substrato novamente, a velocidade aumenta.
é a quantidade de substrato disponível na reação.
é a constante de Michaelis-Menten. Pelo seu valor, exatamente metade de todas as enzimas envolvidas na reação estão ocupadas com um substrato.
No entanto, existem alguns participantes nesta equação que não são dependentes da concentração do substrato. Estes são e . Os dois são propriedades enzimáticas e constantes enzimáticas, respectivamente.
na verdade não é uma constante enzimática real, uma vez que depende da concentração de enzima dada.
no entanto, é uma verdadeira constante enzimática que se aplica a qualquer enzima, independentemente da concentração de enzimas ou substratos.
Equilíbrio de fluxo da equação de Michaelis-Menten
Ao configurar a equação de Michaelis-Menten, você parte de duas suposições . O primeiro requisito é que, quando o substrato se liga à enzima, seja estabelecida uma condição de estado estacionário . O segundo requisito é que o equilíbrio esteja do lado do produto.
Por causa das suposições feitas, a equação de Michaelis-Menten é baseada no estado estacionário simplificado das reações enzimáticas:

E significa enzima, S para substrato, ES para o complexo enzima-substrato e P para o produto. K 1 , k -1 e k 2 são constantes de velocidade. K 1 indica a rapidez com que o complexo enzima-substrato é formado. K -1 e k 2 indicam a rapidez com que o complexo enzima-substrato se decompõe.
É o estado estacionário simplificado porque você pode negligenciar a formação do complexo enzima-produto.
Equação de Michaelis-Menten em geral
Vamos dar uma olhada nos parâmetros individuais da equação de Michaelis-Menten.
Vamos resumir brevemente novamente. A equação é:
![Renderizado por QuickLaTeX.com v_0=\frac{v_m_a_x\cdot[S]} {K_M+[S]}](https://d1g9li960vagp7.cloudfront.net/wp-content/ql-cache/quicklatex.com-db883e9620c4fedce78df3e24c5e5f55_l3.png)
Aqui v 0 representa a taxa inicial, v max para a taxa de reação máxima, [S] para a concentração de substrato e K M para a constante de Michaelis-Menten.
Você pode usar a velocidade inicial v 0 para medir a rapidez com que os substratos se ligam às enzimas nos primeiros segundos da reação. A velocidade máxima v max é a velocidade mais alta que é alcançada na reação enzimática. Nesse ponto, todas as enzimas estão ocupadas por um substrato. Você pode descobrir a quantidade de substrato a partir do valor da concentração de substrato .
Constante de Michaelis-Menten
A constante de Michaelis-Menten , também conhecida como valor KM , corresponde à concentração de substrato na qual metade da velocidade máxima de reação é atingida. Você pode lê-los em um diagrama ou calculá-los usando a equação de Michaelis-Menten . Certifique-se de assistir ao nosso vídeo constante de Michaelis-Menten se quiser saber o que significa um valor alto e baixo de K M.
Diagrama de equação de Michaelis-Menten
Se traçarmos a taxa de reação em função da concentração do substrato, obtemos o chamado diagrama de Michaelis Menten. Isso resulta em uma curva de saturação. Agora vamos ver como você pode ler cada parâmetro do gráfico.
No início da reação você pode determinar a velocidade inicial v 0 .
Você pode descobrir a constante de Michaelis-Menten K M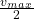 lendo o valor x na metade da velocidade máxima .
lendo o valor x na metade da velocidade máxima .
Após um certo tempo, a reação atinge sua velocidade máxima v max . Isso significa que a reação não pode mais se tornar mais rápida. É por isso que você obtém uma curva semelhante a uma hipérbole no diagrama. A reação enzimática atingiu então o estado de saturação . É por isso que você chama a função de função de saturação ou curva de saturação .
Dependência da atividade da enzima na concentração do substrato
A rapidez com que a saturação é alcançada também depende da concentração do substrato. Isso, por sua vez, influencia a atividade da enzima. Isso significa a eficácia de uma enzima, ou seja, quanto substrato é convertido em um determinado tempo. Vamos olhar mais de perto.
Se a concentração do substrato for baixa , inicialmente apenas algumas enzimas podem se ligar ao substrato. A taxa de reação e a atividade enzimática são consequentemente também baixas. Ambos podem ser aumentados pela adição de substratos. Isso ocorre porque mais substratos podem se ligar às enzimas livres.
Com uma alta concentração de substrato , a atividade da enzima é muito alta. Mas cuidado! Em um certo ponto, a reação não pode mais ficar mais rápida porque todas as moléculas da enzima são ocupadas por um substrato. Quando todas as enzimas estão ocupadas, a chamada saturação é alcançada. Você só poderia aumentar a taxa de reação aumentando a concentração da enzima.
Influência dos inibidores na equação de Michaelis-Menten
Não apenas a concentração do substrato, mas também os inibidores podem influenciar a velocidade da reação. A reação geral é mais lenta com um inibidor competitivo . Em seguida, leva mais tempo para atingir a velocidade máxima. Com um inibidor alostérico , a reação não atinge mais a taxa máxima original.
Derivação da equação de Michaelis-Menten
A equação de Michaelis-Menten é baseada no equilíbrio dinâmico simplificado. Portanto, você pode derivá -lo da lei da ação das massas .
Essencialmente, você pode substituir os parâmetros da equação de Michaelis-Menten por expressões da lei da ação das massas. Isso evita cálculos matemáticos complicados. Além disso, as constantes de velocidade podem ser desprezadas .
Equação de Michaelis Menten – a mais importante
- A equação de Michaelis-Menten pode ser usada para calcular a velocidade de reações controladas enzimaticamente.
- A velocidade da reação enzimática depende (assumindo uma concentração de enzima constante) da concentração do substrato.
- Podemos derivar matematicamente a equação de Michaelis-Menten a partir do equilíbrio dinâmico.
- A constante de Michaelis-Menten descreve a afinidade de uma enzima ao seu substrato.
- O gráfico de Michaelis-Menten é a representação gráfica de nossa equação e é uma curva de saturação.
Equação de Michaelis Menten
O que diz a equação de Michaelis-Menten?
A equação de Michaelis-Menten faz uma afirmação sobre a velocidade de uma reação controlada enzimaticamente. Descreve a dependência da taxa de conversão da enzima na concentração do substrato. Só é válido sob certas condições
O que determina a constante de Michaelis-Menten?
A constante de Michaelis-Menten determina a concentração de substrato na qual exatamente metade das enzimas está ocupada e a reação prossegue na metade da taxa máxima. É, portanto, uma medida da afinidade de uma enzima por seu substrato.
O que significa o valor de km?
O valor Km significa a constante de Michaelis-Menten. É uma medida da afinidade de uma enzima pelo seu substrato. É a concentração de substrato na qual exatamente metade de todas as enzimas são ocupadas por um substrato e a reação ocorre na metade da taxa máxima.